HESA Rapport du Comité
Si vous avez des questions ou commentaires concernant l'accessibilité à cette publication, veuillez communiquer avec nous à accessible@parl.gc.ca.
AMÉLIORER L’ACCÈS AUX TRAITEMENTS POUR LES CANADIENS ATTEINTS DE MALADIES ET DE TROUBLES RARES
Introduction
Le 18 avril 2018, le Comité permanent de la santé de la Chambre des communes (le Comité) a adopté la motion suivante :
Que, conformément à l’article 108(2) du Règlement, le Comité entreprenne une étude sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines afin d’élaborer des recommandations sur les mesures que le gouvernement fédéral peut prendre, en partenariat avec les provinces et les territoires, pour éliminer ces difficultés; que le comité fasse rapport de ses conclusions et recommandations à la Chambre au plus tard le 31 décembre 2018; que, conformément à l’article 109 du Règlement, le Comité demande au gouvernement de déposer une réponse globale au rapport[1].
Dans le cadre de son étude, le Comité a tenu cinq réunions et entendu 24 témoins, dont des fonctionnaires, des médecins, des chercheurs, des représentants de l’industrie pharmaceutique et des groupes de patients, et a reçu 10 mémoires. Le présent rapport, produit à partir des témoignages recueillis, s’amorce par un survol des maladies rares au Canada. En deuxième lieu, le rapport contient l’analyse des difficultés avec lesquelles les Canadiens atteints de maladies rares doivent composer pour accéder au traitement, des difficultés que l’on peut regrouper dans les domaines suivants : l’homologation des médicaments destinés au traitement des maladies rares; la fixation du prix des médicaments; le remboursement des médicaments par les régimes provinciaux et territoriaux d’assurance‑médicaments; l’accès aux diagnostics. Le rapport se termine par les observations et recommandations du Comité sur les façons dont le gouvernement fédéral peut remédier à ces difficultés en collaboration avec les provinces et les territoires.
Survol des maladies rares au Canada
Lors de sa comparution devant le Comité, Mme Catherine Parker (directrice générale, Direction des produits biologiques et des thérapies génétiques, Direction générale des produits de santé et des aliments, ministère de la Santé) a expliqué qu’une « maladie rare est une condition mortelle ou débilitante, ou une infection chronique grave qui ne touche qu’un nombre restreint de patients[2] » et a ajouté qu’aucune norme internationale n’existe pour définir ce que constitue une maladie rare. Les définitions actuelles ont surtout pour objectif d’établir la rareté d’une maladie en fonction de sa prévalence, de la proportion de la population atteinte ou de son incidence – soit le nombre de nouveaux cas diagnostiqués chaque année[3]. Mme Parker a aussi expliqué que, pour Santé Canada, une maladie rare est une maladie qui touche moins de 5 Canadiens sur 10 000, une définition similaire à celle adoptée par l’Union européenne. Cette définition comprend certaines maladies considérées comme ultra-rares et qui peuvent toucher moins de 10 Canadiens à l’échelle du pays. Lors de sa comparution, M. Joel Lexchin (professeur émérite, School of Health Policy and Management, York University) a précisé que toute définition de ce que constitue une maladie rare devrait tenir compte non seulement de la fréquence ou de la rareté de la maladie, mais également de sa gravité et de l’ampleur de ses conséquences débilitantes[4].
Le Comité a appris qu’environ 80 % des maladies rares sont génétiques, ce qui veut dire qu’elles sont causées par des changements ou des mutations à au moins 1 des 20 000 gènes composant le génome humain[5]. Ces maladies apparaissent souvent dès la naissance ou durant la petite enfance[6]. Dr Alex MacKenzie (clinicien-chercheur de l’Hôpital pour enfants de l’Est de l’Ontario) a expliqué que, selon les estimations actuelles, il y aurait environ 7 000 maladies rares et que, pour environ 94 % d’entre elles, il n’existe ni traitement ni médicament[7].
En ce qui concerne les répercussions des maladies rares sur la population canadienne, différents chiffres ont été communiqués au Comité. Selon l’Organisation canadienne des maladies rares, 3 millions de Canadiens, ce qui représente 1 Canadien sur 12, sont atteints d’une maladie rare[8]. D’autres témoins, dont MM. Mackenzie, Lexchin et Doug Coyle (professeur, École d’épidémiologie, de santé publique et de médecine préventive, Université d’Ottawa), ont dit penser qu’il s’agit d’une surestimation de la prévalence des maladies rares au Canada[9]. Selon Dr Mackenzie, les preuves indiquent plutôt qu’environ un million de Canadiens, soit 2 ou 3 % de la population, sont atteints d’une maladie rare[10].
Dr Mackenzie a ajouté que les enfants sont touchés de façon disproportionnée[11] : environ 50 % des Canadiens touchés par une maladie rare sont des enfants. Ceux‑ci composent le tiers des patients admis en pédiatrie à l’hôpital. Le tiers des décès qui surviennent durant la première année de vie sont causés par des maladies rares, et le tiers des enfants qui ont une maladie rare mourront avant cinq ans. Par conséquent, en termes d’années de vie perdues[12] dans la population générale, les maladies rares ont des répercussions disproportionnées au Canada par rapport à d’autres maladies :
La statistique la plus révélatrice est peut-être que la proportion des années de vie perdues en raison des maladies rares représente environ 4,6 %. Ce sont des années de vie perdues dans la société canadienne. Pour les maladies infectieuses, cette proportion est d’environ 1,4 % à 1,6 %. Pour le diabète, ce n’est que 2,6 %. C’est vraiment dramatique. Je pense que cela est attribuable au fait que ces maladies entraînent des décès tôt dans la vie, et l’incidence est donc disproportionnée[13].
Pour terminer, Dr Mackenzie a affirmé qu’environ 50 % des Canadiens atteints d’une maladie rare n’ont jamais reçu de diagnostic sur leur maladie[14].
Difficultés d’accès au traitement pour les Canadiens atteints de maladies rares : ce que le comité a entendu
Sur la question des difficultés avec lesquelles les Canadiens atteints de maladies rares doivent composer pour accéder au traitement nécessaires, les témoins ont mis en évidence quatre catégories de difficultés : autorisation de mise en marché; fixation du prix des médicaments; remboursement des médicaments par les régimes provinciaux et territoriaux d’assurance‑médicaments; accès aux tests diagnostiques. On trouvera ci‑dessous le survol des principales difficultés dans chacune des catégories ainsi que des mesures qui pourraient être prises par le gouvernement fédéral pour y remédier.
Autorisation de mise en marché des médicaments destinés au traitement des maladies rares
Conformément à la Loi sur les aliments et drogues[15] ainsi qu’au Règlement sur les aliments et drogues (partie C, titre 8)[16], Santé Canada dispose du pouvoir de régir l’innocuité, l’efficacité et la qualité des médicaments, y compris les médicaments destinés au traitement des maladies rares au Canada. Mme Catherine Parker (Santé Canada) a expliqué au Comité que le Règlement prévoit notamment la surveillance des essais cliniques des médicaments qui font leur entrée sur le marché canadien[17]. En outre, Santé Canada délivre les autorisations de mise en marché en vertu desquelles on permet la vente de nouveaux médicaments après en avoir évalué les bienfaits et les risques du point de vue de la qualité, de l’innocuité et de l’efficacité. Enfin, le Ministère vérifie aussi l’innocuité de ces médicaments après leur mise en marché, ce qu’on appelle la pharmacovigilance post‑commercialisation. Dans le cas des maladies rares, Mme Parker a expliqué au Comité que le système offre aux Canadiens trois solutions : l’approbation accélérée ou la priorisation de médicaments; le Programme d’accès spécial; les essais cliniques[18].
Approbation des médicaments à statut prioritaire pour le traitement des maladies rares
Mme Parker (Santé Canada) a expliqué que son ministère accélère le processus d’approbation des médicaments destinés au traitement des maladies graves ou potentiellement mortelles, ce qui comprend les maladies rares[19]. Le Ministère donne à ces médicaments un statut prioritaire ou les approuve de façon conditionnelle pour que les patients y accèdent plus rapidement. De 30 à 40 % de tous les médicaments approuvés au Canada sont des médicaments qui visent à traiter des maladies rares[20]. En 2017, 16 des 36 nouveaux médicaments de marque déposée autorisés par Santé Canada avaient la désignation de médicaments orphelins (c.‑à‑d. des médicaments destinés au traitement des maladies rares) en Europe ou aux États-Unis[21]. Mme Parker a expliqué que la plupart de ces médicaments sont évalués puis approuvés grâce à des processus accélérés. Elle a ajouté que le Ministère a rendu les exigences réglementaires appliquées à l’approbation des médicaments conformes aux exigences d’autres organes de réglementation, de manière à ce que les sociétés pharmaceutiques puissent déposer une seule demande pour l’ensemble des organes de réglementation. Ainsi, Santé Canada et la U.S. Food and Drug Administration (FDA) offrent désormais un portail commun qui permet aux sociétés pharmaceutiques de présenter une demande d’homologation auprès des deux organes simultanément[22]. Selon une recherche du Conseil d’examen du prix des médicaments brevetés, il en résulte que 9 des 10 médicaments orphelins les plus vendus aux États-Unis sont désormais offerts au Canada[23]. Mme Parker a toutefois noté qu’à Santé Canada, on sait qu’il faut faire plus, d’où le projet entrepris pour examiner le processus d’approbation des médicaments d’ordonnance, y compris les médicaments destinés au traitement des maladies rares, pour le rendre plus efficace et mieux répondre aux besoins des patients et du système de soins de santé[24].
Certains témoins[25], bien que généralement favorables au processus d’approbation accéléré en vigueur à Santé Canada pour offrir aux patients atteints de maladies rares les médicaments dont ils ont besoin, ont proposé des solutions pour améliorer l’homologation. Selon le Dr Craig Campbell (neurologue en pédiatrie, Hôpital pour enfants de London), il faut que les organismes de réglementation adoptent un processus d’examen intégral plus souple des preuves scientifiques pour l’homologation de médicaments[26]. À son avis, les organismes de réglementation du Canada ne tiennent pas compte de l’ensemble des catégories de données disponibles pour évaluer l’efficacité des médicaments pour les maladies rares, comme celles sur la qualité de vie, les répercussions sur le quotidien, l’analyse des coûts et les méta-analyses :
[…] dans presque toutes les interactions que j’ai eues avec les organismes de réglementation canadiens aux travaux desquels j’ai participé, les membres du personnel de ces organismes disaient que les examens des dossiers de médicaments pour les maladies rares peuvent être et seront effectués avec plus de souplesse et plus de considération pour le contexte et la totalité des données. Par ailleurs, ils affirment souvent que les processus d’approbation actuels et les mécanismes d’examen des données probantes sont adaptables aux médicaments contre les maladies rares. Et pourtant il semble que ce soit rarement le cas au regard des décisions finales qui sont prises[27].
« [I]ls affirment souvent que les processus d’approbation actuels et les mécanismes d’examen des données probantes sont adaptables aux médicaments contre les maladies rares. Et pourtant il semble que ce soit rarement le cas au regard des décisions finales qui sont prises. »
Dr Craig Campbell, neurologue en pédiatrie, Département de pédiatrie et neurologie, Hôpital pour enfants de London
Selon ce qu’a entendu le Comité, il faut assouplir et élargir l’examen des preuves scientifiques sur les médicaments pour les maladies rares, car il est difficile de les soumettre à des essais cliniques selon les normes usuelles, et ce, pour différentes raisons : le petit nombre d’individus pouvant participer en raison de la rareté de la maladie; l’absence de groupe témoin; le peu de connaissances sur les maladies rares elles-mêmes[28]. Pour remédier au problème, Dr Campbell a recommandé que les organismes de réglementation adoptent les lignes directrices GRADE – ce qui signifie classement des recommandations, évaluation, élaboration et évaluation – pour l’examen des données probantes[29]. Il a aussi recommandé la création d’un groupe d’examen indépendant qui donnerait des conseils à toutes les autorités compétentes appelées à étudier des médicaments destinés au traitement des maladies rares[30].
En raison des défis liés à la recherche et au développement des médicaments destinés au traitement des maladies rares, d’autres témoins, comme des représentants de l’Organisation canadienne des maladies rares, des Janssen Pharmaceutical Companies, de Horizon Therapeutics Canada et du Forum canadien des innovateurs concernant les maladies rares (i‑RARE), ont recommandé à Santé Canada d’élaborer un processus de réglementation propre à ces médicaments, ce qui a été fait ailleurs, notamment aux États-Unis et dans l’Union européenne[31]. À l’intérieur de ce cadre de réglementation propre aux médicaments pour les maladies rares, on pourrait prévoir des mesures visant à inciter les sociétés à concevoir et à commercialiser des médicaments pour les maladies rares au Canada, un processus de désignation des médicaments orphelins, des dispositions sur l’exclusivité du marché, des fonds pour la promotion de la recherche, des incitatifs fiscaux et des réductions de frais applicables au dépôt d’une demande[32].
Lors de sa comparution, M. Joel Lexchin a toutefois dit penser que si Santé Canada mettait sur pied un processus propre aux médicaments pour les maladies rares, il ne serait pas nécessaire d’y inclure des incitatifs monétaires ou fiscaux, puisque ces médicaments représentent actuellement 37 % des médicaments approuvés aux États‑Unis[33]. Il serait plus utile d’investir dans la recherche. Il a aussi dit que la désignation des médicaments orphelins ne devrait s’appliquer qu’aux médicaments foncièrement uniques, soit ceux qui ne peuvent traiter qu’une seule maladie, plutôt qu’aux médicaments conçus pour traiter des sous-groupes de maladies ou différentes maladies qui ont en commun des causes génétiques similaires. De plus, Santé Canada devrait exiger que les essais cliniques des médicaments pour les maladies rares s’effectuent avec la plus grande rigueur, même si les populations de patients sont petites. De plus, dans le cas des médicaments dont les avantages cliniques ne sont pas clairement prouvés, le Ministère devrait obliger les sociétés à poursuivre les essais cliniques même après la mise en marché des médicaments[34]. Comme susmentionné, M. Lexchin a aussi recommandé que la définition adoptée par Santé Canada de ce que constitue une maladie rare comporte des précisions sur la fréquence et la gravité de la maladie.
Programme d’accès spécial
Selon ce que le Comité a entendu de fonctionnaires de Santé Canada, le Programme d’accès spécial (PAS) constitue un autre chemin d’accès important aux médicaments destinés au traitement des maladies rares[35]. Selon Mme Parker, le PAS de Santé Canada permet à des patients atteints d’une maladie grave ou potentiellement mortelle d’accéder à des médicaments non approuvés, de façon exceptionnelle et au cas par cas, lorsque les traitements conventionnels ont échoué, qu’ils ne conviennent pas aux patients ou qu’ils sont inaccessibles[36]. Pour obtenir des médicaments par l’entremise de ce programme, M. John Patrick Stewart (directeur général, Direction des produits thérapeutiques, Santé Canada) a déclaré que le médecin doit soumettre une demande au programme et « [i]l incombe alors au médecin d’expliquer pourquoi ce traitement est celui qui convient le mieux pour son patient, de démontrer que la vie de celui-ci est en danger, d’indiquer que les autres traitements disponibles, le cas échéant, ont été considérés et jugés inappropriés en l’espèce, et de fournir toute autre justification à l'appui de ce traitement[37]. » Ces demandes étant exceptionnelles, M. Stewart a ajouté que l’utilisation des médicaments est généralement autorisée pour des périodes de trois à six mois seulement, car l’examen sur la qualité, l’innocuité et l’efficacité du médicament ne se déroule pas selon les normes habituelles. Le Comité a appris qu’environ 30 % des médicaments auxquels on demande d’accéder par l’entremise de ce programme sont des médicaments orphelins[38].
Des témoins ont dit voir le PAS comme une solution importante pour accéder à un traitement pour les maladies rares[39]. Ils ont toutefois aussi pointé du doigt différentes difficultés liées à la gestion du programme en prenant pour exemple les problèmes vécus par des médecins et des patients ayant tenté, en 2017, d’accéder à un médicament pour traiter le cystinose. Le Comité a appris que la cystinose est une maladie métabolique rare et incurable qui touche entre 75 et 100 enfants et jeunes adultes canadiens[40]. Si elle n’est pas traitée, la maladie provoque une insuffisance rénale de stade final, en moyenne avant que le patient ait atteint l’âge de 9 ans[41]. Selon le néphrologue et pédiatre Julian Midgley, le traitement primaire pour la cystose est un médicament appelé le Cystagon, approuvé par la FDA en 1994[42]. Le fabricant du Cystagon n’a jamais demandé l’autorisation de commercialiser son médicament au Canada et, par conséquent, les patients qui l’utilisent ici y accèdent par l’entremise du PAS depuis 20 ans.
Le Comité a appris qu’en juin 2017, Santé Canada a délivré un avis de conformité ou une autorisation de mise en marché pour le Procysbi, un autre médicament visant à traiter la cystinose[43]. Dr Midgley a expliqué que le nouveau médicament contient les mêmes ingrédients actifs que le Cystagon, mais que ce dernier était plus durable et améliorait l’adhésion des adolescents et des adultes à leur traitement. Il a toutefois précisé que, parce qu’aucune étude à long terme n’avait été faite sur son efficacité, de nombreuses familles préféraient conserver le médicament qui s’était avéré efficace. De plus, le coût du Procysbi est considérablement plus élevé que celui du Cystagon; la cystéamine coûte 35,05 $ par comprimé de 75 milligrammes, ce qui représente 400 000 $ par année par comparaison à 10 000 $ par année pour le Cystagon. Lorsque le Procysbi a été approuvé au Canada, selon Dr Midgley, le Ministère a donné l’impression aux médecins que le Cystagon ne serait plus disponible par l’entremise du PAS[44]. Toutefois, lorsque des préoccupations au sujet du coût du Procysbi ont émergé, Santé Canada a continué d’approuver les demandes de Cystagon pour répondre aux besoins médicaux, sans toutefois indiquer selon quels critères le médicament continuerait d’être accessible par l’entremise du PAS[45]. De plus, alors qu’auparavant on pouvait, conformément au programme, accéder aux médicaments pour une période de six mois, cet accès a baissé à trois ou quatre mois.
Mme Erin Little, présidente de la Liv-A-Little Foundation, a expliqué au Comité que l’incertitude quant à l’accès continu au Cystagon a été très éprouvante pour les médecins, les patients et leurs familles :
Lorsque le Procysbi a été approuvé et que le Cystagon a été éliminé abruptement au Canada et au moment où notre lettre d’annulation nous a été envoyée, notre médecin a été surprise, parce qu’elle n’avait pas été informée de l’approbation du Procysbi et qu’elle n’estimait pas qu’il s’agissait nécessairement du meilleur choix pour ses patients. Lorsque notre néphrologue a parlé avec un représentant de Santé Canada en expliquant de vive voix les raisons médicales pour lesquelles Olivia devait poursuivre son traitement actuel, ce choix lui a été refusé et nous avons été terrifiés par ce qui allait arriver ensuite. Nous avons été surpris qu’une personne, peu importe son haut niveau de scolarité, qui est assise dans son bureau, qui ne connaît ni la cystinose ni notre enfant, ait pu prendre une telle décision et contourner l’avis de la médecin de notre enfant. En tant que principale fournisseuse de soins d’Olivia et personne qui fait confiance à ses médecins et au système de santé, j’ai été dégoûtée qu’on ne permette pas à notre médecin de prendre cette décision extrêmement importante pour sa patiente[46].
Dans une lettre de suivi subséquente que le Comité a reçue en janvier 2019, la ministre de la Santé a apporté des précisions supplémentaires à propos de la réponse du Ministère concernant l’accès au Cystagon par l’entremise du PAS lorsque le Procysbi a commencé à être commercialisé au Canada. D’après cette lettre, Santé Canada avait d’abord annulé les demandes existantes concernant le Cystagon dans le cadre du PAS. Une lettre a ensuite été envoyée à chaque médecin qui avait demandé du Cystagon par l’entremise du PAS pour qu’il fournisse une justification médicale indiquant pourquoi leurs patients avaient encore besoin de ce médicament et ne pouvaient pas prendre à la place le Procysbi, un médicament approuvé et mis en marché au Canada. Les médecins ont aussi été contactés directement par un professionnel de la santé par l’entremise du PAS, qui leur a expliqué qu’ils pouvaient refaire une demande pour du Cystagon plutôt que pour du Procysbi s’ils avaient une raison médicale de le faire. La lettre indique ensuite que plus de 60 patients ont pu se procurer du Cystagon par l’entremise du Programme d’accès spécial depuis la mise en marché du Procysbi.
« Nous avons été surpris qu’une personne, peu importe son haut niveau de scolarité, qui est assise dans son bureau, qui ne connaît ni la cystinose ni notre enfant, ait pu prendre une telle décision et contourner l’avis de la médecin de notre enfant. En tant que principale fournisseuse de soins d’Olivia et personne qui fait confiance à ses médecins et au système de santé, j’ai été dégoûtée qu’on ne permette pas à notre médecin de prendre cette décision extrêmement importante pour sa patiente. »
Mme Erin Little, présidente, Liv-A-Little Foundation
Le Comité a appris que, pour réagir plus efficacement à ce genre de situation, Santé Canada doit mieux communiquer aux médecins les critères du PAS relativement aux besoins médicaux et veiller à ce que les patients aient accès aux médicaments offerts par l’entremise du programme pour des périodes plus longues[47]. Selon des patients et des médecins, le Ministère devrait également, avant de prendre des décisions, mieux tenir compte des besoins des patients et du système de soins de santé et examiner notamment le coût potentiel des médicaments[48]. Enfin, des témoins ont dit que le cas du Cystagon montre bien que Santé Canada doit prévoir des incitatifs pour que les fabricants qui offrent des médicaments par l’entremise du PAS présentent des demandes de commercialisation au Canada, et ce, en suivant le processus normal d’homologation[49].
Accès aux médicaments pour les maladies rares par l’entremise des essais cliniques
« Malheureusement pour Norm, pendant l’interruption de son traitement, la maladie a progressé et il a subi une perte de capacité fonctionnelle, ce qui a directement causé deux chutes graves. Les blessures causées par ces chutes ont nécessité une hospitalisation et notamment des épidurales, afin de soulager la douleur causée par la blessure au dos. »
Mme Tammy Moore, directrice générale, Société canadienne de la sclérose latérale amyotrophique
Selon Mme Parker (Santé Canada), les essais cliniques réalisés par les sociétés pharmaceutiques et autorisés par Santé Canada offrent aux patients atteints de maladies rares l’accès à de nouveaux traitements[50]. Le Ministère offre aux fabricants des conseils sur la conception des essais cliniques pour les petites populations de patients et dispose d’une base de données sur les essais cliniques qui aide les patients et les fournisseurs de soins de première ligne à trouver les essais cliniques les plus adéquats auxquels participer. Si ces essais constituent une façon d’accéder à de nouveaux traitements, le Comité a appris que, souvent, les patients peinent à continuer d’accéder au traitement une fois l’essai clinique terminé[51]. Par exemple, Mme Tammy Moore (directrice générale, Société canadienne de la sclérose latérale amyotrophique) a raconté l’histoire de Norm, qui a fait l’essai d’un médicament, et ce, sans effet indésirable. À la fin de l’essai clinique, le fabricant était prêt à lui fournir le médicament. Il était toutefois tenu de d’abord présenter à Santé Canada une demande de prolongation ouverte, un processus qui peut nécessiter jusqu’à six semaines. Mme Moore a expliqué que l’attente a des conséquences très négatives sur la santé des patients :
Malheureusement pour Norm, pendant l’interruption de son traitement, la maladie a progressé et il a subi une perte de capacité fonctionnelle, ce qui a directement causé deux chutes graves. Les blessures causées par ces chutes ont nécessité une hospitalisation et notamment des épidurales, afin de soulager la douleur causée par la blessure au dos[52].
Pour remédier à ce genre de situation, Mme Moore a recommandé que Santé Canada accorde automatiquement une prolongation ouverte à la fin des essais cliniques, dans la mesure où aucune inquiétude quant à l’innocuité du médicament n’émerge pendant l’essai. C’est l’approche adoptée par la FDA, aux États-Unis.
Le prix des médicaments pour les maladies rares
Le Comité a appris que le gouvernement fédéral est également responsable – par l’entremise du Conseil d’examen du prix des médicaments brevetés (CEPMB) – de la réglementation des prix des médicaments brevetés, ce qui comprend les médicaments destinés au traitement des maladies rares. M. Douglas Clark (directeur exécutif, CEPMB) a expliqué au Comité que son organisation a été créée en 1987 conformément à la Loi sur les brevets dans la foulée d’une série de réformes qui visaient à stimuler l’investissement dans la recherche et le développement pharmacologiques au Canada grâce à une meilleure protection des brevets pour les sociétés pharmaceutiques[53]. Selon M. Clark :
Le CEPMB est un organisme quasi judiciaire dont le mandat réglementaire est de veiller à ce que les brevetés n’abusent pas de leurs brevets en facturant aux consommateurs des prix excessifs pendant leur période de monopole réglementaire. Sa création découle de la préoccupation selon laquelle une meilleure protection des brevets des médicaments entraîne une hausse inacceptable des prix au point de les rendre inabordables pour les consommateurs[54].
M. Clark a expliqué que le CEPMB se prononce sur le prix des médicaments brevetés et juge s’il est excessif ou non par l’analyse de l’avantage thérapeutique qu’il procure par rapport aux médicaments actuellement sur le marché. Une fois le prix fixé, le CEPMB en contrôle la hausse en se fondant sur les variations de l’indice des prix à la consommation et le prix de vente du même médicament dans sept autres pays, soit la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis, qui forment ce qu’on appelle les pays du PMPRB7[55]. Le Comité a appris que le processus du CEPMB nécessite environ trois mois[56]. S’il juge le prix d’un médicament excessif, le CEPMB peut tenir des audiences publiques et ordonner la réduction du prix ou le remboursement des recettes excessives.
Malgré les plafonds fixés par le CEPMB, des témoins ont indiqué au Comité que l’une des grandes difficultés liées à l’accès aux médicaments pour les maladies rares est leur prix élevé, qui compromet la viabilité financière des régimes privés et publics d’assurance-médicaments[57]. Dans son mémoire au Comité, l’Alliance pancanadienne pharmaceutique (APP), qui négocie le prix des médicaments auprès des fabricants au nom des régimes publics d’assurance-médicaments fédéraux, provinciaux et territoriaux, a expliqué que le prix courant des médicaments pour les maladies rares varie de 0,5 million à 4,9 millions de dollars par personne annuellement[58]. Les maladies rares étant des maladies chroniques de par leur nature, le traitement d’un patient pendant 10 ans peut coûter entre 1 million et 49 millions de dollars[59]. Dans son mémoire au Comité, le i-RARE a précisé que, même si le coût par patient est très élevé, l’impact budgétaire général de ces médicaments est relativement peu important : ils n’ont composé que de 3,3 à 5,6 % des dépenses pharmaceutiques totales entre 2007 et 2013[60]. Ces dépenses devraient demeurer en dessous du seuil de 6 % des dépenses pharmaceutiques globales jusqu’en 2018. Le Comité a toutefois aussi entendu qu’on s’attend, avec le temps, à ce que ces médicaments représentent une part de plus en plus importante des budgets des régimes publics et privés d’assurance-médicaments, dans un contexte où 50 % des nouveaux médicaments brevetés par le CEPMB ont obtenu la désignation de médicaments orphelins aux États-Unis ou dans l’Union européenne[61]. Par conséquent, M. Clark a expliqué que ces médicaments peuvent gravement compromettre la viabilité financière du système de soins de santé :
Notre système peut absorber un ou deux ou peut-être même une dizaine de médicaments à coût très élevé, mais il s’écroulera s’il y en a des centaines, peu importe leur qualité. Ultimement, le seul déterminant de l’accès est le prix. Le meilleur médicament du monde n’apportera rien à la société si personne ne peut se le permettre ou si le fait de l’offrir à quelques fortunés prive le plus grand nombre de soins de santé adéquats[62].
Selon le i-RARE, les fabricants de ces médicaments vendent ces derniers à prix fort en raison des risques et des coûts entraînés par la recherche et le développement. Parmi les risques, on note le manque de connaissances sur les maladies rares : parce qu’on en sait trop peu, les essais cliniques se soldent souvent par des échecs. En raison des petites populations de patients touchés par ces maladies, il faut aussi trouver d’autres moyens de produire des données lors des essais cliniques[63]. Mais surtout, les prix élevés s’expliquent par la nécessité de recouvrer les coûts de la recherche et du développement auprès d’un marché de peu d’envergure du fait de la rareté des maladies visées[64].
« Le meilleur médicament du monde n’apportera rien à la société si personne ne peut se le permettre ou si le fait de l’offrir à quelques fortunés prive le plus grand nombre de soins de santé adéquats. »
M. Douglas Clark, directeur exécutif, Conseil d’examen du prix des médicaments brevetés (CEPMB)
Néanmoins, selon d’autres témoins, comme MM. Lexchin, Midgley et Coyle[65] ainsi que l’APP, les fabricants de médicaments destinés au traitement des maladies rares doivent faire preuve d’une plus grande transparence sur les coûts de recherche et de développement de leurs médicaments pour en justifier le prix fort. Dans sa présentation au Comité, l’APP a soutenu que, malgré ce que déclarent les fabricants, les preuves semblent montrer que la vente de leurs médicaments leur rapporte des profits considérables. Par exemple, une étude de 2016 a révélé que, pour les fabricants, les médicaments destinés au traitement des maladies rares sont cinq fois plus rentables que les autres types de médicaments[66]. L’APP a fait des demandes répétées aux fabricants pour que ceux-ci justifient « leurs prix extrêmement élevés, aucune justification transparente n’a été fournie jusqu’à maintenant[67] ». L’APP a soutenu que, sans justification transparente, les consommateurs et le public sont forcés d’arriver à la « conclusion que les prix sont établis principalement en fonction d’objectifs de maximisation des bénéfices plutôt que de reprise de la R‑D[68] ».
Pour composer avec le prix élevé des médicaments destinés au traitement des maladies rares et d’autres médicaments complexes, des témoins ont indiqué au Comité qu’il faut modifier le cadre réglementaire régissant le prix des médicaments brevetés en instaurant la proposition de modification du Règlement sur les médicaments brevetés publiée dans la Gazette du Canada le 2 décembre 2017[69]. M. Clark a expliqué que le gouvernement fédéral envisageait trois grands types de changements par cette proposition[70]. Premièrement, on élargirait le nombre de pays utilisés pour comparer les prix de manière à inclure les pays dont le prix des médicaments se rapproche des prix médians de l’OCDE ainsi que des économies et des systèmes de soins de santé similaires à ceux du Canada. On propose donc d’inclure les pays suivants dans l’annexe : l’Australie, la Belgique, la France, l’Allemagne, l’Italie, le Japon, les Pays-Bas, la Norvège, la Corée du Sud, l’Espagne, la Suède ainsi que le Royaume-Uni, qui forment ainsi le CEPMB12[71]. Deuxièmement, on propose de modifier le Règlement afin d’y intégrer de nouveaux facteurs pour déterminer si un prix est excessif, notamment en examinant le prix à l’aune de sa valeur pour les patients en termes d’accroissement de la durée et de la qualité de vie, ainsi que la part du marché éventuelle du nouveau médicament par rapport au produit intérieur brut[72]. En troisième lieu, on obligerait le fabricant à fournir au CEPMB des rapports sur les prix et les recettes nets de tout rajustement de prix, comme des rabais ou des remises consentis au public ou aux participants d’un régime privé d’assurance-médicaments afin d’avoir une vision juste des prix des médicaments sur le marché[73].
Le Comité a appris que les fabricants s’opposent aux changements proposés au Règlement[74]. Dans son mémoire, le i-RARE a affirmé que les changements auraient des effets disproportionnés sur les médicaments destinés au traitement des maladies rares, ce qui occasionnerait des réductions de prix de 70 à 90 %. L’organisation a ajouté que l’approche proposée pour déterminer la valeur et l’efficacité des médicaments ne tient pas compte des contraintes intrinsèques à la production de preuves scientifiques sur les médicaments destinés au traitement des maladies rares. Selon i‑RARE, les changements mettraient des bâtons dans les roues aux fabricants tentant d’obtenir des autorisations de mise en marché au Canada, ce qui nuira aux patients, car ceux-ci devront attendre plus longtemps pour obtenir leur traitement ou y auront accès de façon restreinte. Il a donc été recommandé au gouvernement fédéral de réexaminer cette proposition[75].
M. Clark a expliqué au Comité que le CEPMB est conscient que les changements proposés à son cadre réglementaire pourraient retarder ou compromettre l’accès des Canadiens aux tous derniers médicaments brevetés, et il comprend les préoccupations que cela suscite[76]. Il a toutefois informé le Comité qu’il existe peu de données probantes à l’appui de l’argument selon lequel des prix plus bas entraînent un accès plus limité. Voici ce qu’il en a dit : « La réalité, c’est que de nombreux pays qui ont des systèmes de santé similaires et des économies semblables à ceux du Canada paient moins pour leurs médicaments tout en bénéficiant d’un accès égal ou meilleur. Il en va de même pour les investissements en recherche et développement[77]. »
Le Comité a appris en outre que le Canada arrive actuellement au troisième rang des pays qui payent leurs médicaments brevetés le plus cher au monde, et que son ratio de recherche et développement comparativement aux ventes fait pâle figure par rapport à celui des pays du CEPMB7 avec lesquels il se compare[78]. Selon M. Clark :
À l’origine, la composition de ce groupe était fondée sur l’hypothèse que, si nous imitions les types de régimes de PI dans ces pays et que nos prix correspondaient aux leurs, nous pourrions jouir d’un niveau de recherche et de développement similaire aux leurs. Évidemment, cette hypothèse ne s'est pas confirmée au fil du temps. Actuellement, notre ratio de recherche et de développement comparativement aux ventes est à un creux historique […] Il s’élève actuellement à 4,4 %, alors qu’il s’élève à 20 %, en moyenne, dans les pays avec lesquels nous nous comparons au sein du CEPMB7[79].
Toujours selon M. Clark, le CEPMB ne fait « pas un très bon travail » pour protéger les Canadiens contre les prix excessifs avec les outils qu’il a actuellement à sa disposition; c’est la raison pour laquelle il veut aller de l’avant avec les réformes ambitieuses de ses directives en matière de prix[80]. Annoncés pour la première fois en juin 2016, ces changements devaient prendre effet le 1er janvier 2019, mais ils ont encore été reportés à une date indéterminée[81].
Remboursement des médicaments destinés au traitement des maladies rares par les régimes publics d’assurance-médicaments fédéraux, provinciaux et territoriaux
Il revient aux provinces et aux territoires de déterminer quels sont les médicaments – y compris les médicaments pour les maladies rares – qui seront remboursés par leur régime public d’assurance-médicaments respectif[82]. Par ailleurs, le gouvernement fédéral administre un régime public d’assurance-médicaments s’adressant à des groupes précis, comme les militaires, les anciens combattants, les Premières Nations et les Inuits, les personnes incarcérées dans les prisons fédérales, ainsi que certaines catégories de réfugiés[83]. Dans le mémoire présenté au Comité au nom des régimes publics d’assurance-médicaments du Canada, l’APP a indiqué que chaque régime vise à offrir une couverture accessible, adéquate et abordable qui répond aux besoins de la population[84] et qui permet en outre de financer d’autres composantes du système de soins de santé, dont les fournitures et les appareils médicaux ainsi que les services pharmaceutiques. Les régimes doivent aussi faire l’objet de rapports publics pour montrer où va l’argent des contribuables. De plus, il faut faire des compromis pour décider quels médicaments et services seront financés par les systèmes de soins de santé, où l’on gère un grand nombre de priorités concurrentes avec des budgets limités.
« Évidemment, cette hypothèse ne s'est pas confirmée au fil du temps. Actuellement, notre ratio de recherche et de développement comparativement aux ventes est à un creux historique […] Il s’élève actuellement à 4,4 %, alors qu’il s’élève à 20 %, en moyenne, dans les pays avec lesquels nous nous comparons au sein du CEPMB7. »
M. Douglas Clark, directeur exécutif, Conseil d’examen du prix des médicaments brevetés (CEPMB)
Dans son mémoire, l’APP a expliqué que les décisions prises sur la couverture offerte par les régimes publics d’assurance-médicaments fédéraux, provinciaux et territoriaux sont fondées sur des processus nationaux et pancanadiens, notamment ceux de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) ainsi que de l’Alliance pancanadienne pharmaceutique (APP) (voir figure 1)[85]. L’ACMTS et l’APP ont le même objectif : uniformiser les décisions sur le prix et le remboursement des médicaments au pays[86]. L’ACMTS est un organisme indépendant sans but lucratif mis sur pied par les gouvernements fédéral, provinciaux et territoriaux (à l’exception du Québec)[87] en 1989 pour fournir des conseils et des directives afin de déterminer quels médicaments et quelles technologies médicales devraient être remboursés par les régimes publics[88]. Mme Heather Logan (vice-présidente intérimaire, Révisions pharmaceutiques, ACMTS) a expliqué au Comité que, une fois que Santé Canada a autorisé la vente d’un médicament, l’ACMTS fournit aux décideurs des régimes publics ses avis et recommandations en se fondant sur l’évaluation des technologies de la santé (ETS), qui consiste à évaluer, grâce à des données probantes, l’efficacité clinique et le rapport coût-efficacité du médicament[89]. Pour évaluer ce dernier, il faut examiner les avantages cliniques du médicament – qualité de vie, morbidité, mortalité – par comparaison à son coût pour déterminer s’il offre un bon rapport qualité-prix. L’évaluation des technologies de la santé comprend aussi l’examen coût-efficacité d’un médicament par rapport à d’autres traitements disponibles. Elle cerne également dans quelles conditions cliniques et sur quels patients le médicament fonctionne le mieux[90]. Par l’entremise du Programme commun d’évaluation des médicaments, l’ACMTS éclaire les décisions en matière de couverture de 18 des 19 régimes publics d’assurance-médicaments au Canada, y compris les régimes fédéraux. L’ACMTS dispose d’un processus similaire distinct pour évaluer les médicaments oncologiques; il s’agit du Programme pancanadien d’évaluation des anticancéreux[91].
Figure 1
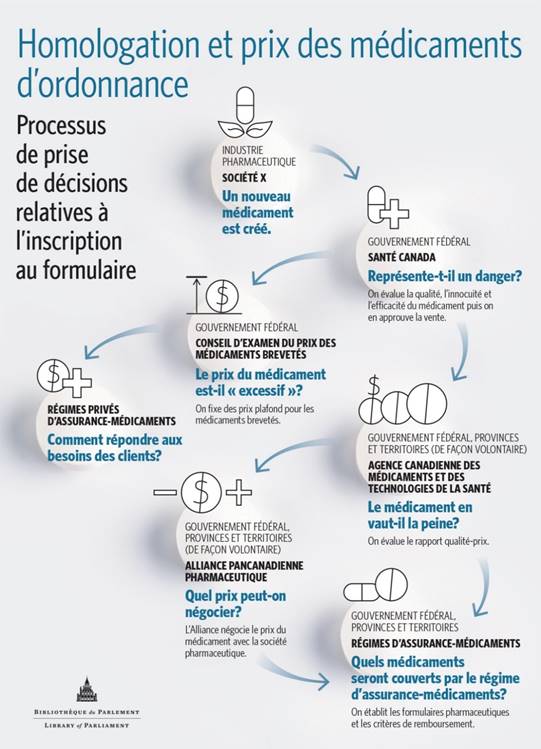
Lorsqu’un médicament est recommandé au terme du processus d’évaluation de l’ACMTS, l’APP, au nom des décideurs des régimes d’assurance-médicaments fédéraux, provinciaux et territoriaux, négocie auprès des sociétés pharmaceutiques pour faire accepter certaines modalités et faire baisser le prix du médicament en vue de l’ajout de ce dernier à la liste des médicaments remboursés[92]. Au terme des négociations, les différents gouvernements concluent des ententes qui leur sont propres avec les sociétés pharmaceutiques. Au 30 décembre 2018, l’APP avait mené 200 processus de négociations à l’égard de médicaments, tant de marque déposée que génériques, ce qui a abouti à des économies de 1,98 milliard de dollars[93]. Au 26 novembre 2018, l’APP avait mené neuf processus de négociations à l’égard de médicaments destinés au traitement des maladies rares[94].
En raison du peu de données cliniques dont on dispose sur ces médicaments, le Comité a appris que l’ACMTS et l’APP peinent à formuler des recommandations sur leur remboursement et à en négocier le prix. Puisque la population ciblée pour ce type de médicaments est petite, il est difficile de faire des essais cliniques qui respectent les normes établies[95]. Dans un contexte où les données produites à l’issue de ces essais sont moins concluantes, l’incertitude demeure grande pour ce qui est des avantages cliniques ainsi que de l’innocuité à long terme du médicament, son efficacité et son rapport coût-efficacité. De plus, les données cliniques se fondent sur des résultats de substitution – comme des changements aux biomarqueurs ou aux processus biologiques – qui peuvent être corrélés avec l’amélioration de la qualité de vie ou la réduction de la mortalité, mais qui n’en sont pas nécessairement la cause[96].
Enfin, dans son mémoire, l’APP a expliqué que lorsque Santé Canada approuve la vente d’un médicament sous réserve de conditions, comme l’obligation de recueillir des preuves additionnelles sur son efficacité, les sociétés pharmaceutiques qui ne respectent pas les conditions sont bien peu pénalisées[97]. Ainsi, lors de l’évaluation subséquente du produit par l’ACMTS et l’APP, il devient difficile d’en établir l’efficacité, par insuffisance ou absence de données probantes. Puisque les preuves sur les répercussions cliniques positives et négatives des médicaments pour les maladies rares manquent de clarté et que le prix des médicaments est élevé, les décideurs des régimes publics d’assurance‑médicaments ont du mal à en justifier le remboursement. L’APP a précisé qu’il existe des médicaments pour les maladies rares dont l’efficacité clinique a été prouvée de façon telle qu’ils sont remboursés sous réserve de conditions, dont souvent la réduction de leur prix et l’obligation d’appliquer des critères cliniques précis pour leur utilisation[98].
Pour remédier à la difficulté d’obtenir les preuves scientifiques nécessaires sur l’efficacité clinique et le rapport coût-efficacité des médicaments pour les maladies rares, Mme Logan (ACMTS) a recommandé d’investir dans l’infrastructure et de soutenir le prélèvement des données[99]. De cette façon, les régimes publics d’assurance-médicaments pourraient rembourser de façon conditionnelle un médicament pour lequel les preuves sont restreintes, puis réévaluer la situation ou renégocier auprès des sociétés pharmaceutiques au fur et à mesure que de nouvelles preuves sont produites; il s’agit d’une approche de gestion utilisée par d’autres administrations[100]. Dr Campbell s’est exprimé dans le même sens et a recommandé d’investir dans les registres des maladies rares, qui permettent aux cliniciens de recueillir, à long terme, des données de haute qualité sur les résultats de santé et les biomarqueurs pour évaluer les nouvelles thérapies[101].
Selon ce que le Comité a entendu, pour améliorer l’accès aux médicaments pour les maladies rares, il faut accélérer les processus de remboursement de l’ACMTS et de l’APP, et ce, en assurant une meilleure coordination entre le travail de ces deux organismes et le processus de Santé Canada sur l’approbation de la mise en marché des médicaments. M. Andrew McFadyen (directeur exécutif, The Isaac Foundation) a expliqué que, même si Santé Canada dispose d’un processus permettant l’évaluation prioritaire de médicaments, des patients se retrouvent souvent sans traitement, car il faut attendre que l’ACMTS fasse sa propre évaluation, un processus qui peut nécessiter de 6 à 12 mois additionnels, puis l’APP doit mener les négociations nécessaires, ce qui peut prendre un an ou plus[102]. Mme Tammy Moore a ajouté que cette longue attente – attendre l’approbation réglementaire, l’évaluation de l’ACMTS, les négociations de l’APP – est particulièrement grave pour les patients atteints de maladies rares, étant donné que leur état de santé peut décliner rapidement s’ils n’ont pas accès à un traitement :
Pendant les 180 jours de la période d’examen prioritaire de Santé Canada, 500 Canadiens sont décédés de la SLA. Combien d’autres décéderont en attendant la décision de l’ACMTS? Ensuite, combien d’autres décéderont pendant qu’ils attendent que le médicament soit accessible par l’entremise d’un programme de médicaments financés par les fonds publics? Les membres de cette communauté mesurent le temps en fonction de la perte de leurs propres capacités fonctionnelles et du nombre d’entre eux qui décéderont pendant ce processus[103].
Afin d’accélérer les processus d’approbation et de remboursement, M. McFadyen a recommandé d’en améliorer la coordination : réaliser de façon simultanée les évaluations de Santé Canada et de l’ACMTS et amorcer les négociations de l’APP en même temps[104]. Mme Parker a indiqué au Comité que Santé Canada commence à travailler en ce sens et coopère avec l’ACMTS pour arriver au déroulement conjoint de leurs processus[105]. L’APP, dans son mémoire, a recommandé que Santé Canada, en collaboration avec l’ACMTS et l’APP, offre aux sociétés pharmaceutiques des conseils et du soutien pour concevoir adéquatement les essais cliniques qui produiront toutes les preuves scientifiques exigées, de manière à faciliter l’approbation de Santé Canada et les processus de négociation sur le prix et le remboursement par les régimes d’assurance-médicaments provinciaux et territoriaux[106].
« Pendant les 180 jours de la période d’examen prioritaire de Santé Canada, 500 Canadiens sont décédés de la SLA. Combien d’autres décéderont en attendant la décision de l’ACMTS? Ensuite, combien d’autres décéderont pendant qu’ils attendent que le médicament soit accessible par l’entremise d’un programme de médicaments financés par les fonds publics? Les membres de cette communauté mesurent le temps en fonction de la perte de leurs propres capacités fonctionnelles et du nombre d’entre eux qui décéderont pendant ce processus. »
Mme Tammy Moore, directrice générale, Société canadienne de la sclérose latérale amyotrophique
Des témoins ont dit qu’il faut prévoir une couverture ponctuelle pour les médicaments destinés au traitement des maladies rares en attendant la fin des processus d’approbation et de remboursement pour que les patients aient un accès continu aux médicaments nécessaires[107]. Le Comité a appris que certaines sociétés pharmaceutiques couvrent le coût des médicaments offerts aux patients en attendant l’issue du processus d’homologation, et ce, grâce à des programmes de soins de compassion. Ces programmes ne sont toutefois pas toujours avantageux pour les patients et les décideurs des régimes publics. Mme Little a souligné qu’une fois inscrits à ces programmes, les patients ont parfois du mal à faire rembourser leurs médicaments par leur compagnie d’assurance privée ou ne peuvent pas changer de traitement si un nouveau médicament arrive sur le marché[108]. Un représentant de l’APP a indiqué que, souvent, on avait vu des sociétés pharmaceutiques menacer de cesser l’approvisionnement de médicaments pour soins de compassion, un argument qu’elles utilisaient dans le cadre de négociations avec les décideurs des régimes publics[109]. M. McFadyen a donc recommandé au gouvernement fédéral de mettre de côté un petit pourcentage des transferts provinciaux et territoriaux pour les soins de santé afin de fournir aux patients l’accès immédiat aux médicaments vitaux approuvés par Santé Canada, mais toujours visés par les processus de l’ACMTS et de l’APP[110].
De façon plus générale, des témoins ont indiqué au Comité que les patients devraient avoir un accès équitable aux médicaments pour les maladies rares, que ce soit grâce à un programme de couverture nationale des médicaments pour les maladies rares, ou grâce à un programme national d’assurance-médicaments universel qui comprendrait les médicaments pour les maladies rares. Voici ce qu’en a dit Mme Maureen Smith (secrétaire, Organisation canadienne des maladies rares) :
J’ai beaucoup d’idées de recommandations, mais ce qui me semble le plus évident, c’est l’absence d’équité dans notre pays. On réagit très mal quand on apprend qu’un patient qui a exactement la même maladie, dans une autre province, reçoit un traitement qu’on se fait refuser dans sa propre province. Les patients qui ne souffrent pas de maladie rare ou ceux qui ne prennent pas de médicaments en sont sidérés. Nous sommes tous Canadiens et nous semblons tous croire que la couverture universelle prévue dans les hôpitaux englobe les médicaments. On comprend peu cette situation tant qu’on ne la vit pas[111].
Enfin, le Comité a appris que des progrès ont été faits pour régler ces problèmes. Mme Logan a expliqué que le groupe de travail sur les médicaments onéreux servant au traitement des maladies rares (MOMR) a été créé par les sous-ministres provinciaux et territoriaux de la Santé en 2014 pour explorer des façons de gérer l’accès à ces médicaments[112]. Le groupe de travail a formulé une proposition comportant la création d’un processus propre aux maladies rares qui viserait :
« On réagit très mal quand on apprend qu’un patient qui a exactement la même maladie, dans une autre province, reçoit un traitement qu’on se fait refuser dans sa propre province. Les patients qui ne souffrent pas de maladie rare ou ceux qui ne prennent pas de médicaments en sont sidérés. Nous sommes tous Canadiens […] »
Mme Maureen Smith, secrétaire, conseil d’administration, Organisation canadienne des maladies rares
- la coordination et la priorisation accrues pour désigner plus tôt les médicaments complexes aux fins des processus d’examen réglementaires;
- la meilleure utilisation des données probantes réelles pour éclairer les évaluations réglementaires et les décisions de remboursement;
- la création de groupes d’experts centralisés pour l’évaluation des preuves et la prise de décisions uniformes;
- l’accès provisoire aux médicaments en attendant les preuves cliniques additionnelles[113].
Le Comité a appris que des consultations sur cette proposition ont eu lieu en novembre 2018. Dans leurs mémoires au Comité, l’APP et les sociétés pharmaceutiques ont recommandé au gouvernement fédéral de soutenir le processus proposé par le groupe de travail sur les MOMR[114].
Accès au diagnostic précoce des maladies rares
M. Michael Brudno (professeur et directeur scientifique, Centre for Computational Medicine, Hospital for Sick Children), a affirmé que le diagnostic précoce, dans le cas des maladies rares, est fondamental pour l’accès aux traitements[115]. On dispose de tests génétiques – 1 000 $ par test – qui permettent d’identifier les mutations qui provoquent des maladies et de reconnaître 7 000 maladies[116]. Lorsque les patients passent rapidement des tests génétiques, ils accèdent aussi rapidement à des traitements et ils évitent les visites inutiles chez différents spécialistes ainsi que les tâtonnements et les interventions qui peuvent coûter au système de soins de santé jusqu’à 8 000 $ US par patient, selon des études menées aux États-Unis. Selon M. Brudno, si le Canada souhaite régler les problèmes d’accès aux traitements des maladies rares, il devra miser sur l’accès rapide aux tests génétiques pour poser des diagnostics précoces. Dr Alex MacKenzie (clinicien‑chercheur, Hôpital pour enfants de l’Est de l’Ontario) a aussi recommandé que le gouvernement fédéral continue d’investir dans les activités de recherche, comme le projet des 30 000 échantillons de Génome Canada ainsi que les projets du consortium de recherche pancanadien Care4Rare, qui travaille à l’identification des gènes à l’origine des maladies rares[117].
L’avenir : Observations et recommandations du Comité
L’étude du Comité a permis de mettre en évidence les nombreuses difficultés avec lesquelles les Canadiens atteints de maladies rares doivent composer pour accéder à des traitements. Le Comité a appris que les processus actuels prévus pour l’approbation des médicaments, la fixation des prix et le remboursement des médicaments pour les maladies rares ne répondent pas aux besoins des patients, des sociétés pharmaceutiques et des décideurs des régimes publics d’assurance‑médicaments des provinces et des territoires. Cette situation crée des tensions importantes entre les différentes composantes du système de soins de santé :
À l’heure actuelle, beaucoup de familles doivent faire défiler leurs enfants dans les médias. Beaucoup de sociétés pharmaceutiques manipulent les médecins et le public. Les cliniciens et les groupes de patients réagissent sous le choc aux décisions. Les règlements et les processus internes semblent étouffer la participation des organismes de réglementation[118].
Il apparaît clairement au Comité que des changements s’imposent. Dans un contexte où de plus en plus de médicaments destinés au traitement des maladies rares arrivent sur le marché canadien, il faut s’attaquer aux prix trop élevés et régler le problème de l’insuffisance de preuves scientifiques sur leur utilisation, tout en garantissant aux patients l’accès continu aux traitements nécessaires. De plus, les sociétés pharmaceutiques doivent pouvoir obtenir des retombées équitables par rapport à leurs investissements et se voir offrir des incitatifs pour présenter, au Canada, des autorisations de mise en marché. Des témoins ont proposé des mesures que le gouvernement fédéral, en collaboration avec les provinces et les territoires, pourrait prendre pour atteindre un juste équilibre entre ces priorités concurrentes et améliorer l’accès aux traitements dont ont besoin les Canadiens atteints de maladies rares. Des témoins ont mis en évidence la nécessité d’établir un processus distinct et coordonné en vue de faciliter les autorisations de mise en marché et le remboursement des médicaments pour les maladies rares, et ce, dans l’ensemble des administrations publiques. Par ce processus distinct, prévoyant l’étude générale et assouplie des preuves scientifiques relatives aux médicaments destinés au traitement des maladies rares, on garantirait un accès rapide à ceux-ci. Des témoins ont aussi déclaré que Santé Canada doit mieux expliquer aux médecins et aux patients ses décisions et critères réglementaires, en particulier dans le cadre du Programme d’accès spécial. Santé Canada doit aussi fournir des directives aux sociétés pharmaceutiques pour veiller à ce que celles‑ci puissent fournir les preuves scientifiques nécessaires tant pour l’approbation de mise en marché que pour le remboursement des médicaments pour les maladies rares.
Enfin, des témoins ont formulé l’idée que le facteur qui détermine véritablement si on pourra accéder aux médicaments pour les maladies rares est leur prix. Par conséquent, on a dit au Comité qu’il faut adopter la proposition qui vise à modifier le Règlement sur les médicaments brevetés pour réduire le prix des médicaments au Canada et assurer la viabilité financière des systèmes de soins de santé publics. Des témoins ont aussi recommandé que le gouvernement fédéral finance des programmes publics d’assurance-médicaments à court et à long terme pour que les patients ayant besoin de médicaments pour les maladies rares y aient accès. Pour l’heure, les investissements publics dans la recherche sur les maladies rares contribueront à la mise au point de nouveaux traitements et à la surveillance de l’efficacité des traitements actuels.
En accord avec les propositions formulées par les témoins durant son étude, le Comité recommande :
Autorisations de Santé Canada pour la mise en marché de médicaments destinés au traitement des maladies rares
Recommandation 1
Que le gouvernement du Canada, en collaboration avec les provinces et les territoires, mette sur pied un processus conjoint pour autoriser la mise en marché et le remboursement des médicaments destinés au traitement des maladies rares.
Recommandation 2
Que le gouvernement du Canada travaille à plus de transparence et de partage de l’information tout au long du cycle de vie des médicaments destinés au traitement des maladies rares, afin que les principaux décideurs, notamment les prestataires de soins de santé, les évaluateurs des technologies de la santé et les patients, puissent y avoir accès rapidement.
Recommandation 3
Que le gouvernement du Canada, en collaboration avec les provinces et les territoires, mette sur pied un groupe d’examen national et indépendant composé d’experts dont le mandat sera de formuler des recommandations et des conseils sur l’homologation, la fixation des prix et le remboursement des médicaments pour les maladies rares au Canada, ainsi que de donner des instructions sur la façon de rationaliser les processus; et que ce groupe fasse publiquement rapport de ses conclusions.
Recommandation 4
Que Santé Canada et l’Agence canadienne des médicaments et des technologies de la santé lancent en même temps leurs processus respectifs d’évaluation scientifique des médicaments pour les maladies rares, et en fassent une pratique courante.
Recommandation 5
Que Santé Canada, en collaboration avec l’Agence canadienne des médicaments et des technologies de la santé, offre des conseils et des avis aux sociétés pharmaceutiques sur la conception de leurs essais cliniques pour garantir le respect des exigences de l’intégralité des processus prévus au Canada pour l’autorisation de mise en marché et le remboursement des médicaments pour les maladies rares.
Recommandation 6
Que Santé Canada examine la possibilité de supprimer les exigences réglementaires qui obligent les sociétés pharmaceutiques à obtenir une approbation additionnelle pour la prolongation ouverte d’un médicament au terme de l’essai clinique, pour que les patients continuent d’accéder au traitement dont ils ont besoin, dans la mesure où aucune préoccupation n’est soulevée quant à son innocuité, conformément aux pratiques réglementaires en vigueur aux États‑Unis.
Recommandation 7
Que Santé Canada examine l’idée de réduire les frais pour le dépôt d’une demande d’homologation imposés aux sociétés pharmaceutiques qui veulent faire autoriser la mise en marché de leurs médicaments pour les maladies rares au Canada.
Recommandation 8
Que Santé Canada communique de façon proactive avec les médecins et les patients pour expliquer les critères médicaux précis à respecter pour accéder à des médicaments par l’entremise du Programme d’accès spécial.
Recommandation 9
Que le gouvernement du Canada supprime l’obligation de refaire une demande par l’entremise du Programme d’accès spécial tous les trois à six mois pour avoir accès à un médicament pour une maladie permanente et stable. Les demandes approuvées une première fois devraient demeurer valides jusqu’à ce qu’un médecin les annule ou que l’état du patient change considérablement.
Recommandation 10
Que Santé Canada veille à ce que les sociétés pharmaceutiques respectent les obligations réglementaires qui leur échoient en vertu de tout avis de conformité leur étant délivré sous réserve de conditions relativement à des médicaments pour lesquels les preuves sur l’innocuité, la qualité, et l’efficacité sont restreintes.
Prix des médicaments
Recommandation 11
Que le gouvernement du Canada adopte la proposition modifiant le Règlement sur les médicaments brevetés pour régler le problème du prix élevé des médicaments au Canada.
Recommandation 12
Que le gouvernement du Canada examine l’idée d’établir des exigences distinctes afin d’imposer, aux médicaments pour maladies rares, des prix plafonds conformément au Règlement sur les médicaments brevetés pour tenir compte du petit marché auquel se destinent ces médicaments au Canada.
Recommandation 13
Que le Conseil d’examen du prix des médicaments brevetés soit obligé de tenir compte des conseils et des recommandations du comité consultatif indépendant sur les médicaments destinés au traitement des maladies rares dont on propose la création pour fixer les prix plafonds de ces médicaments.
Recommandation 14
Que le gouvernement du Canada ajoute des exigences réglementaires aux termes de l’alinéa 88(1)c) de la Loi sur les brevets pour obliger les fabricants de produits pharmaceutiques brevetés à informer le Conseil d’examen du prix des médicaments brevetés des coûts engendrés par la recherche et le développement de leurs médicaments lorsqu’ils obtiennent l’autorisation de mise en marché de Santé Canada.
Recommandation 15
Que le gouvernement du Canada entreprenne un examen de l’ensemble du processus de recherche pharmaceutique et de fabrication pour mieux voir là où la réglementation et les lois ont des effets inattendus sur l’augmentation du coût final des médicaments pour les patients. Cet examen devrait également porter sur la possibilité de réduire les coûts des médicaments grâce à la science ouverte.
Remboursement des médicaments destinés au traitement des maladies rares
Recommandation 16
Que le gouvernement du Canada, en collaboration avec les provinces, les territoires et les sociétés pharmaceutiques, mette sur pied un programme de soins de compassion financé de façon conjointe pour rembourser les coûts des médicaments destinés au traitement des maladies rares tandis qu’ils sont évalués pour l’autorisation de mise en marché et de remboursement.
Recommandation 17
Qu’on intègre le remboursement des médicaments destinés au traitement des maladies rares au programme national d’assurance-médicaments créé par le gouvernement du Canada, en collaboration avec les provinces et les territoires, et ce, en modifiant la Loi canadienne sur la santé conformément à la recommandation du Comité permanent de la santé de la Chambre des communes dans son rapport intitulé Un régime d’assurance-médicaments universel pour tous les canadiens : une nécessité.
Recommandation 18
Que le Bureau du vérificateur général effectue un audit auprès de Santé Canada pour déterminer si le Ministère a géré efficacement son accord de financement avec l’Agence canadienne des médicaments et des technologies de la santé, notamment pour établir si Santé Canada veille adéquatement à ce que l’Agence remplisse son mandat conformément aux conditions de son accord.
Recherche
Recommandation 19
Que le gouvernement du Canada, par l’entremise des Instituts de recherche en santé du Canada, finance la recherche sur le diagnostic des patients atteints de maladies rares ainsi que la cueillette de données probantes sur l’efficacité des traitements de ces maladies.
[1] Chambre des communes, Comité permanent de la santé (HESA), Procès-verbal, 1re session, 42e législature, 18 avril 2018.
[2] HESA, Témoignages, 27 septembre 2018, 0900 (Mme Catherine Parker, directrice générale, Direction des produits biologiques et des thérapies génétiques, Direction générale des produits de santé et des aliments, ministère de la Santé).
[3] Ibid.
[4] HESA, Témoignages, 25 octobre 2018, 0835 (M. Joel Lexchin, professeur émérite, School of Health Policy and Management, York University, à titre personnel).
[5] Ibid., 0830 (M. Michael Brudno, professeur et directeur scientifique, Centre for Computational Medicine, Hospital for Sick Children).
[6] HESA, Témoignages, 27 septembre 2018, 0900 (Parker).
[7] HESA, Témoignages, 25 octobre 2018, 0835 (Dr Alex MacKenzie, clinicien-chercheur, Hôpital pour enfants de l’Est de l’Ontario (HEEO)).
[8] HESA, Témoignages, 27 septembre 2018, 0945 (Mme Durhane Wong-Rieger, présidente-directrice générale, Organisation canadienne des maladies rares).
[9] HESA, Témoignages, 25 octobre 2018, 0835 (Lexchin et Mackenzie) et HESA, Témoignages, 4 octobre 2018, 1005 (M. Doug Coyle, professeur, École d’épidémiologie, de santé publique et de médecine préventive de l’Université d’Ottawa, à titre personnel).
[10] Ibid., 0835 (MacKenzie).
[11] Ibid.
[12] Les années de vie perdues offrent une mesure de la mortalité prématurée et se calculent comme le nombre de décès à chaque âge, multiplié par la norme mondiale pour le nombre d’années de vie considérées comme perdues lors d’un décès à chaque âge. En prenant en compte l’âge auquel survient le décès, cet indicateur accorde plus de poids aux maladies entraînant des pertes de vie prématurées. OMS, Years of lives lost (percentage of total) [disponible en anglais seulement].
[13] Ibid.
[14] Ibid.
[15] Loi sur les aliments et drogues, L.C.R. 1985, ch. F‑27.
[16] Règlement sur les aliments et drogues, C.R.C., ch. 870.
[17] HESA, Témoignages, 27 septembre 2018, 0900 (Parker).
[18] Ibid.
[19] Ibid.
[20] Ibid.
[21] Ibid.
[22] Ibid., 0940.
[23] Ibid., 0905.
[24] Ibid.
[25] Voir, par exemple, HESA, Témoignages, 27 septembre 2018, 0945 (Wong-Rieger) et HESA, Témoignages, 4 octobre 2018, 0905 (M. Andrew McFadyen, directeur exécutif, The Isaac Foundation).
[26] HESA, Témoignages, 4 octobre 2018, 0915 (Dr Craig Campbell, neurologue en pédiatrie, Département de pédiatrie et neurologie, Hôpital pour enfants de London, à titre personnel).
[27] Ibid.
[28] HESA, Témoignages, 27 septembre 2018, 0915 (M. John Patrick Stewart, directeur général, Direction des produits thérapeutiques, ministère de la Santé) et le Forum canadien des innovateurs concernant les maladies rares (i‑RARE), Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au Comité HESA, 20 novembre 2018.
[29] HESA, Témoignages, 4 octobre 2018, 0915 (Campbell).
[30] Ibid., 0920.
[31] HESA, Témoignages, 27 septembre 2018, 0945 (Wong-Rieger); i-RARE, Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au Comité HESA, 20 novembre 2018; Horizon Therapeutics Canada, Les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire, présenté en octobre 2018; Janssen Pharmaceutical Companies, Mémoire de l’entreprise Janssen en réponse aux consultations du Comité permanent de la santé de la Chambre des communes sur les obstacles à l’accès à des traitements et des médicaments pour les Canadiennes et Canadiens souffrant de maladies rares, mémoire, présenté le 25 octobre 2018.
[32] i-RARE, Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au HESA, 20 novembre 2018.
[33] HESA, Témoignages, 25 octobre 2018, 0840 (Lexchin).
[34] Ibid.
[35] HESA, Témoignages, 27 septembre 2018, 0900 (Parker).
[36] Ibid.
[37] HESA, Témoignages, 30 octobre 2018, 1025 (Stewart).
[38] HESA, Témoignages, 27 septembre 2018, 0900 (Parker).
[39] Ibid., 0945 (Wong-Rieger); i-RARE, « Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares », mémoire présenté au Comité HESA, 20 novembre 2018; et Horizon Therapeutics Canada, Les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire, présenté en octobre 2018.
[40] HESA, Témoignages, 4 octobre 2018, 0845 (Dr Julian Midgley, pédiatre néphrologue, à titre personnel).
[41] HESA, Témoignages, 30 octobre 2018, 0910 (Mme Erin Little, présidente, Liv-A-Little Foundation).
[42] HESA, Témoignages, 4 octobre 2018, 0850 (Midgley).
[43] Ibid.
[44] Ibid.
[45] Ibid.
[46] HESA, Témoignages, 30 octobre 2018, 0910 (Little).
[47] HESA, Témoignages, 4 octobre 2018, 0850 (Midgley) et i-RARE, Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au Comité HESA, 20 novembre 2018.
[48] HESA, Témoignages, 4 octobre 2018, 0850 (Midgley) et HESA, Témoignages, 30 octobre 2018, 0910 (Little).
[49] HESA, Témoignages, 27 septembre 2018, 0940 (Parker et Stewart).
[50] Ibid., 0900 (Parker).
[51] Ibid., 1005 (Mme Tammy Moore, directrice générale, Société canadienne de la sclérose latérale amyotrophique).
[52] Ibid.
[53] HESA, Témoignages, 6 novembre 2018, 0850 (M. Douglas Clark, directeur exécutif, Conseil d’examen du prix des médicaments brevetés (CEPMB)).
[54] Ibid.
[55] Ibid. et CEPMB, Rapport annuel, 2017.
[56] HESA, Témoignages, 6 novembre 2018, 0940 (Clark).
[57] Ibid. et Alliance pancanadienne pharmaceutique (APP), Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[58] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté Comité au HESA, 7 décembre 2018, p. 5.
[59] Ibid.
[60] i-RARE, Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au Comité HESA, 20 novembre 2018.
[61] ESA, Témoignages, 6 novembre 2018, 0850 (Clark).
[62] Ibid., 0855 (Clark).
[63] i-RARE, Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au Comité HESA, 20 novembre 2018, p. 3‑6.
[64] Ibid., p. 6.
[65] HESA, Témoignages, 4 octobre 2018, (Midgley, Coyle); HESA, Témoignages, 25 octobre 2018, 0840 (Lexchin); et APP, « Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines », mémoire présenté au Comité HESA, 7 décembre 2018.
[66] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[67] Ibid., p. 5.
[68] Ibid., p. 6.
[69] Ibid. et HESA, Témoignages, 4 octobre 2018, 0900 (Coyle) et HESA, Témoignages, 6 novembre 2018, 0850 (Clark).
[70] HESA, Témoignages, 6 novembre 2018, 0930 (Clark).
[71] Gazette du Canada, Règlement modifiant le Règlement sur les médicaments brevetés, vol. 151, no 48, 2 décembre 2017.
[72] HESA, Témoignages, 6 novembre 2018, 0930 (Clark).
[73] Ibid.
[74] i-RARE, Approche unique nécessaire : Aborder les obstacles à l’accès aux traitements contre les maladies rares, mémoire présenté au Comité HESA, 20 novembre 2018, p. 7.
[75] Ibid.
[76] HESA, Témoignages, 6 novembre 2018, 0855 (Clark).
[77] Ibid.
[78] Ibid.
[79] Ibid., 0905.
[80] Ibid., 0925.
[81] The Globe and Mail, « Canada’s drug-pricing regulator brings rare allegation of excessive pricing against Horizon Pharma », 18 janvier 2019.
[82] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[83] Ibid.
[84] Ibid.
[85] Ibid.
[86] Ibid.
[87] Le Québec a son propre processus d’évaluation des technologies de la santé, dont s’occupe l’Institut national d’excellence en santé et en services sociaux.
[88] HESA, Témoignages, 6 novembre 2018, 0855 (Mme Heather Logan, vice-présidente intérimaire, Révisions pharmaceutiques, Agence canadienne des médicaments et des technologies de la santé).
[89] Ibid.
[90] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité au HESA, 7 décembre 2018.
[91] HESA, Témoignages, 6 novembre 2018, 0855 (Logan).
[92] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[93] Ibid.
[94] Ibid.
[95] HESA, Témoignages, 6 novembre 2018, 0855 (Logan).
[96] Ibid.
[97] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[98] Ibid.
[99] HESA, Témoignages, 6 novembre 2018, 0950 (Logan) et APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[100] Ibid.
[101] HESA, Témoignages, 4 octobre 2018, 0920 (Campbell).
[102] Ibid., 0910 (McFadyen).
[103] HESA, Témoignages, 27 septembre 2018, 1005 (Moore).
[104] HESA, Témoignages, 4 octobre 2018, 0910 (McFadyen).
[105] HESA, Témoignages, 27 septembre 2018, 0905 (Parker).
[106] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[107] HESA, Témoignages, 6 novembre 2018, 0855 (Logan).
[108] HESA, Témoignages, 30 octobre 2018, 0940 (Little).
[109] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[110] HESA, Témoignages, 4 octobre 2018, 0910 (McFadyen).
[111] HESA, Témoignages, 27 septembre 2018, 1030 (Mme Maureen Smith, secrétaire, conseil d’administration, Organisation canadienne des maladies rares).
[112] HESA, Témoignages, 6 novembre 2018, 0855 (Logan).
[113] APP, Mémoire au Comité permanent de la santé de la Chambre des communes sur les difficultés d’accès au traitement et aux médicaments pour les Canadiens atteints de maladies rares et orphelines, mémoire présenté au Comité HESA, 7 décembre 2018.
[114] Ibid.
[115] HESA, Témoignages, 25 octobre 2018, 0830 (Brudno).
[116] Ibid.
[117] Ibid., 0835 (MacKenzie).
[118] HESA, Témoignages, 4 octobre 2018, 0915 (Campbell).